También es posible definir la temperatura en términos de la
segunda ley de la termodinámica, la cual dice que la
entropía de todos los sistemas, o bien permanece igual o bien aumenta con el tiempo, esto se aplica al Universo entero como sistema termodinámico.
[2] La entropía es una medida del desorden que hay en un sistema. Este concepto puede ser entendido en términos estadísticos, considere una serie de tiros de monedas. Un sistema perfectamente ordenado para la serie, sería aquel en que solo cae cara o solo cae cruz. Sin embargo, existen múltiples combinaciones por las cuales el resultado es un desorden en el sistema, es decir que haya una fracción de caras y otra de cruces. Un sistema desordenado podría ser aquel en el que hay 90% de caras y 10% de cruces, o 60% de caras y 40% de cruces. Sin embargo es claro que a medida que se hacen más tiros, el número de combinaciones posibles por las cuales el sistema se desordena es mayor; en otras palabras el sistema evoluciona naturalmente hacia un estado de desorden máximo es decir 50% caras 50% cruces de tal manera que cualquier variación fuera de ese estado es altamente improbable.
Para dar la definición de temperatura con base en la segunda ley, habrá que introducir el concepto de
máquina térmica la cual es cualquier dispositivo capaz de transformar calor en
trabajo mecánico. En particular interesa conocer el planteamiento teórico de la
máquina de Carnot, que es una máquina térmica de construcción teórica, que establece los límites teóricos para la eficiencia de cualquier máquina térmica real.

Aquí se muestra la máquina térmica descrita por Carnot, el calor entra al sistema a través de una temperatura inicial (aquí se muestra como
TH) y fluye a través del mismo obligando al sistema a ejercer un trabajo sobre sus alrededores, y luego pasa al medio frío, el cual tiene una temperatura final (
TC).
En una máquina térmica cualquiera, el trabajo que esta realiza corresponde a la diferencia entre el calor que se le suministra y el calor que sale de ella. Por lo tanto, la eficiencia es el trabajo que realiza la máquina dividido entre el calor que se le suministra:
 (1)
(1)
Donde
Wci es el trabajo hecho por la máquina en cada ciclo. Se ve que la eficiencia depende sólo de
Qi y de
Qf. Ya que
Qi y
Qf corresponden al calor transferido a las temperaturas
Ti y
Tf, es razonable asumir que ambas son funciones de la temperatura:
 (2)
(2)
Sin embargo, es posible utilizar a conveniencia, una escala de temperatura tal que
 (3)
(3)
Sustituyendo la ecuación (3) en la (1) relaciona la eficiencia de la máquina con la temperatura:
 (4)
(4)
Hay que notar que para
Tf = 0 K la eficiencia se hace del 100%, temperaturas inferiores producen una eficiencia aún mayor que 100%. Ya que la
primera ley de la termodinámica prohíbe que la eficiencia sea mayor que el 100%, esto implica que la mínima temperatura que se puede obtener en un sistema microscópico es de 0 K. Reordenando la ecuación (4) se obtiene:
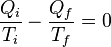 (5)
(5)
Aquí el signo negativo indica la salida de calor del sistema. Esta relación sugiere la existencia de una
función de estado S definida por:
 (6)
(6)
Donde el subíndice indica un proceso reversible. El cambio de esta función de estado en cualquier ciclo es cero, tal como es necesario para cualquier función de estado. Esta función corresponde a la entropía del sistema, que fue descrita anteriormente. Reordenando la ecuación siguiente para obtener una definición de temperatura en términos de la entropía y el calor:
 (7)
(7)
Para un sistema en que la entropía sea una función de su energía interna
E, su temperatura esta dada por:
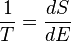 (8)
(8)
Esto es, el recíproco de la temperatura del sistema es la razón de cambio de su entropía con respecto a su energía.

 (1)
(1) (2)
(2) (3)
(3) (4)
(4)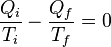 (5)
(5) (6)
(6) (7)
(7)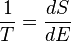 (8)
(8)
No hay comentarios:
Publicar un comentario